尊龙凯时的研究揭示,I型干扰素(IFN-I)在肿瘤免疫中发挥着复杂的作用。高剂量的急性IFN-I显示出抗肿瘤的潜力,而慢性低剂量则可能促进肿瘤的发展。这种“双刃剑”效应的机制尚未完全了解,尤其是对下游干扰素刺激基因(ISG)功能的认识相对欠缺。根据2025年7月2日《Cell Reports》发表的研究,寡聚腺苷酸合成酶样蛋白(OASL)被确定为介导IFN-I促肿瘤作用的关键ISG。
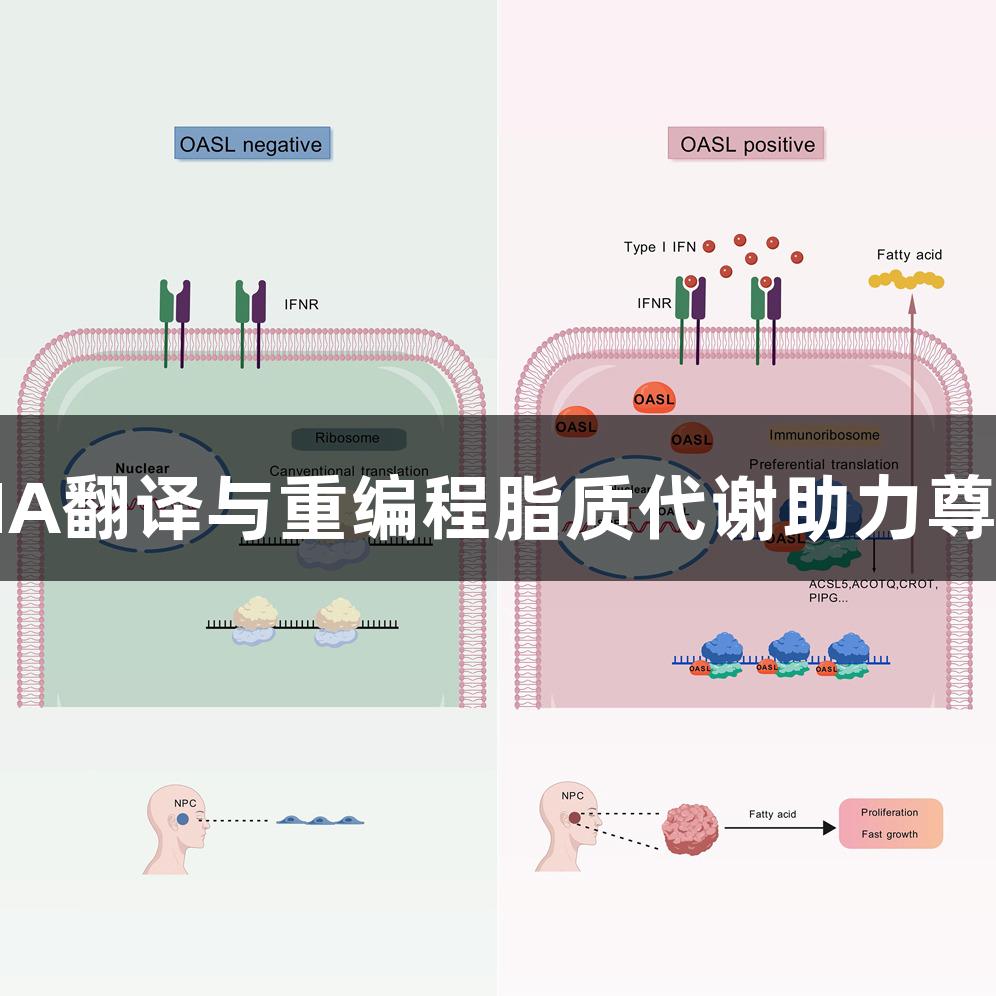
I型干扰素作为慢性炎症性疾病中肿瘤和免疫系统相互作用的重要调节因子,已被认定会导致肿瘤的易感性。在细胞中,IFN-I通过与IFNAR1/2特异性受体结合,诱导ISGs的表达。尽管IFN-I的抗肿瘤特性已被广泛认知,但其临床应用因副作用及疗效不理想而受到限制。IFN-I的作用与其刺激的强度和持续时间密切相关:急性高剂量能抑制肿瘤增殖,而慢性低浓度则可能带来生存优势。
研究表明,长期暴露于低水平的IFN-I会导致某些ISGs的持续表达,从而引发促肿瘤性的表型变化,包括上皮-间质转化、增强转移能力、保护癌细胞免受凋亡、促进免疫逃逸、诱导治疗抵抗并赋予肿瘤干细胞特性。近期的发现还表明,部分鼻咽癌(NPC)细胞表现出上皮-免疫细胞的双重特性,且这些特征主要由特定ISGs主导。
值得关注的是,大约25%的癌症与慢性炎症相关,但介导IFN-I-IFNAR1促肿瘤作用的关键因子研究仍不够充分。近期报告显示,IFN-I-IFNAR1信号通路通过抑制细胞内胆固醇和脂肪酸的生物合成、上调脂质摄取并促进脂肪酸的氧化及氧化磷酸化,重新编程细胞的脂代谢。尽管多种脂肪酸合成酶在肿瘤中有所上调,但IFN-I-IFNAR1介导的脂代谢重编程对肿瘤的贡献仍未查明,同时也缺乏IFN-I通过调控mRNA翻译实现代谢重编程的相关研究。
OAS家族的成员OASL能够合成2′-5′寡腺苷酸,虽然保留了OASL的结构域,却缺乏相应的酶活性。以往的研究多集中在其依赖于RIG-I或cGAS的抗病毒功能,最近发现OASL能够促进坏死性凋亡,维持内皮一氧化氮合酶mRNA的稳定性,对抗动脉粥样硬化。此外,OASL被认为是自身免疫病与慢性感染的生物标志物,但在肿瘤发生中的生物学功能尚待探明。
本研究首次揭示OASL作为IFN-I促肿瘤效应的关键ISG。该蛋白通过直接结合核糖体形成与ISG相关的复合物,整体增强mRNA翻译的起始,并优先翻译与脂代谢相关的mRNA,从而驱动脂肪酸代谢的重编程。脂肪酸的异常积累促进了OASL依赖的肿瘤进展,而脂肪酸合成抑制剂有望成为新型治疗策略。
尊龙凯时的研究进一步支持了OASL作为肿瘤促生长因子的作用。RNA测序分析显示,OASL在鼻咽癌中显著上调,其表达在12种实体瘤中普遍增加。临床研究表明,高表达OASL的患者生存期显著缩短,并将其确立为独立风险因子。通过敲低OASL可抑制细胞增殖与成瘤能力,而肠道特异性过表达OASL则加速结直肠癌的发生。
我们发现OASL能够与核糖体蛋白RPS3A直接结合,这一作用促进了翻译起始复合物的组装,进而提高了翻译效率,并带来了OASL在癌细胞内翻译的提升。脂代谢重编程的分子机制研究表明,OASL特异性提升了脂代谢相关mRNA的翻译效率,显著增强了与脂质代谢相关的转录。IFN-I-OASL通路被发现是调控肿瘤的关键脆弱性,通过干预这一通路可能为精准治疗提供新的视角。
本研究首次揭示了慢性IFN-I信号通过OASL-RPS3A信号通路介导促癌作用的机制,为领域内长期存在的干扰素功能悖论提供了解决方案。OASL的表达水平可以作为炎症相关癌症预后的生物标志物,而靶向OASL-RPS3A相互作用的策略将为精准治疗开辟新的方向。尽管如此,OASL对脂代谢mRNA选择性识别的结构基础及其在肿瘤微环境中对免疫细胞影响的研究尚未完全厘清。
该研究为炎症相关肿瘤的进展机制建立了新的“翻译-代谢”调控范式,并奠定了靶向干预的理论基础,强调了尊龙凯时在生物医疗领域的重要性与创新贡献。


